Главные достижения лаборатории в фундаментальной науке:
- Лабораторное определение термодинамических и кинетических характеристик, необходимых для описания геохимических процессов
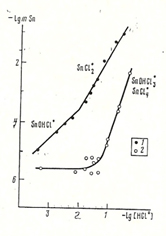
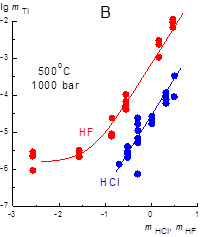
1) Экспериментально определена растворимость окислов Sn, Ti, Zr и U в растворах HCl, HF, H2SO4, NaOH, Na2CO3, NaHCO3, NaCl, NaF при 500оС, 1000 бар. Из данных по растворимости рассчитаны константы реакции растворения и константы устойчивости комплексов: Sn(OH)20, SnCl20, SnCl3-, SnOHCl0, Sn(OH)2Cl-, SnF20, SnOHF0.; Ti(OH)3Cl0, Ti(OH)2Cl20, Ti(OH)2SO40, Ti(SO4)20, Ti(OH)5-, Ti(OH)62, Ti(OH)3F0Ti(OH)2F20, Ti(OH)4F-; Zr(OH)2SO40, Zr(SO4)20, Zr(OH)3F0, Zr(OH)2F20, Zr(OH)5- ; UO2(aq) U(OH)2Cl20, UOHCl30, U(OH)3F0, U(OH)2F20 .
  |    |
| Растворимость касситерита | Растворимость рутила |
Из экспериментальных исследований вытекает: (а) основными формами переноса указанных элементов являются гидроксохлоридные и гидроксофторидные комплексы; (б) экспериментально доказана преобладающая роль форм Sn(II) в гидротермальных флюидах, что принципиально изменило геолого-минералогические представления о Sn-рудообразовании; (в) в системе «Au-UO2-флюид» присхдит окисление золота и последующее восстановление и переотложение, что проливает свет на формирование золото-урановой минерализации (типа Витватерсранд).


вкрапленники золота на уранините
2) Экспериментально изучены механизмы и кинетики реакций растворения алюмосиликатов и кремнезема в водных растворах

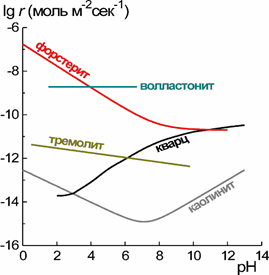
Типы зависимостей скоростей растворения минералов от рН раствора
Наряду с экспериментальным определением выполнено обобщение данных по зависимостям скоростей реакций растворения породообразующих минералов от температуры, рН, состава раствора и степени его насыщения. На рис. в качестве примера приведены основные типы рН-зависимостей. Были суммированы также данные о зависимости скоростей химического выветривания горных пород и минералов в природных условиях от водного стока, температуры, литологии и физической эрозии, выявлены причины расхождения полевых и лабораторных кинетических данных.
Получены уравнения скоростей реакций взаимного превращения натриевого и калиевого полевого шпата, которые использованы для оценки погрешности показаний Na/K геотермометра.
Для реакции калишпатизации альбита при 300°С выведены уравнения скоростей конгруэнтного растворения первичного альбита и осаждения вторичного санидина в зависимости от степени насыщения раствора. Между конгруэнтной и инконгруэнтной стадиями обнаружен длительный индукционный период, в течение которого реакция практически прекращается вследствие трудностей зародышеобразования вторичного минерала. Установлено взаимное влияние скоростей растворения первичного альбита и осаждения вторичного КПШ. Обнаружен репликационный механизм реакции, объясняющий явление псевдоморфизма.
Установлено, что осаждение кремнезема из раствора при 200-300°С происходит на 3 порядка медленнее, чем его растворение. Это свидетельствует о нарушении принципа микроскопической обратимости реакций и объясняется медленным зародышеобразованием метастабильных модификаций кремнезема.
II. Моделирование гидрогеохимических процессов
Используя методику физико-химического компьютерного моделирования и обширную информацию о химическом составе природных вод установлены основные физико-химические параметры, которые определяют формирование и изменение химического состава природных вод земной коры: (а) петрохимический тип пород (состав макрокомпонентов, но особенно концентрации и формы нахождения летучих); (б) соотношение между массами прореагировавших породы и воды, R/W (зависит от интенсивности водообмена); (в) температура-давление и термодинамическая открытость-закрытость системы «вода-порода-газы» относительно СО2 и О2 (зависит от глубинности объекта и контакта с источником углекислоты). Знание указанных характеристик позволяет количественно описывать гидрогеохимические процессы и оценивать экологический риск на объектах окружающей среды. Покажем примеры
1) Разрешение K-Na биогеохимического парадокса
В современных водах земной коры K<Na. Моделированием было установлено: формирование водного раствора с K>Na возможно в системах «вода-вещество углистого хондрита» и «вода-вещество примитивной мантии» и невозможно в системе «вода-основная или кислая породы» (рис). Возникновение жизни на Земле происходило в водной фазе (pH=9,5±0,5, Eh=-450±50 mV) в восстановительной N2-CO2-CH4 атмосфере в первые сотни миллионов лет при дифференциации хондритового вещества на ядро (3FeO=Fe+Fe2O3) и мантию, но дальнейшая дифференциация вещества и образование современных пород земной коры привели к такому изменению водной фазы, что K<Na.
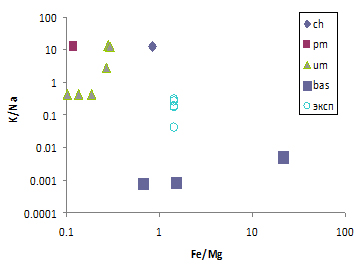

Отношение K/Na в водной фазе систем «вода-углистый хондрит (ch), примитивная мантия (pm), вещество ультраосновного состава (um), вещество основного состава (bas)» при P CO2 10-7бар и P CH4 10-6 бар, 25оС как функция Fe/Mg в минеральном веществе системы; экспериментальные данные при 125оС (эксп)
2) Причиной повышения концентрации фтора в подземных водах Молдавии является возрастание Na/Ca отношения, которое, в свою очередь, является следствием увеличения R/W в более глубоких горизонтах
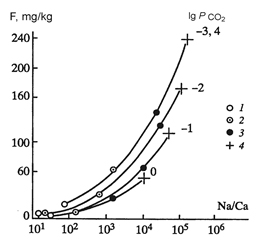  |  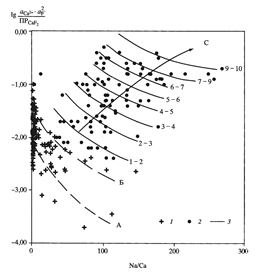 |
| Изменение содержания фтора в водной фазе системы «порода-вода» как функция Na/Ca для заданных R/W=0.2-20 (1-4) и Р СО2 | Приближение реальных подземных вод к насыщению по CaF2; числа справа - концентрации F (мг/л) в реальных подземных водах горизонта N1S1 (Молдавия) |
3) Накопления фтора в водах Московского артезианского бассейна обусловлено снижением равновесного парциального давления углекислоты
 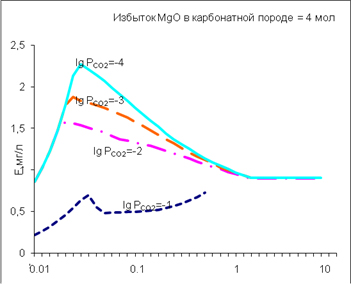 | Изменение содержания F в водном растворе системы «карбонатная порода(c CaF2) - вода» при изменение отношения вода-порода (R/W) при различных равновесных парциальных давлениях СО2 |
4) Загрязнение подземных вод мышьяком (КНР) обусловлено десорбцией As при снижении Eh подземных вод вследствие их загрязнения бытовыми отходами
5) Воздействие отходов металлургического производства на окружающую среду происходит вследствие перехода в раствор As, V и Si (десорбция) и других элементов (реакции растворения-осаждения).
6) Формирование кислотного дренажа на сульфидсодержащих месторождениях является следствием проникновения кислорода атмосферы в смоченные водой участки породы, окисления сульфидной серы. Образующаяся серная кислота реагирует с минералами породы, понижает рН, что было показано моделированием и в лабораторных опытах. Нормируемые компоненты из сульфидных и алюмосиликатных минералов переходят в водную фазу в зависимости от состава породы и величин pH и Eh, сложившихся в системе порода - вода на данный момент времени.
Реальную опасность загрязнения природных вод представляют участки мелкодробленой рудной породы (хвосты), находящиеся в режиме смены пассивного и активного водообмена. Моделированием показано, что пассивный водообмен (высокие R/W) благоприятен накоплению продуктов окисления сульфидов, а активный водообмен (пониженные R/W) – вымыванию продуктов окисления из породы
 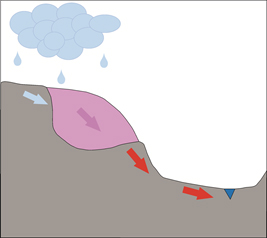 | Кислый раствор, содержащий повышенные концентрации нормируемых элементов стекает в реку, озеро и другие источники водоснабжения |
- Процессы гидротермального минералообразования
1) Для закрытых систем «вода-порода», описывающих постмагматическое гидротермальное минералообразование моделированием показано, что поровые воды горных пород характеризуются щелочной реакцией и высоким восстановительным потенциалом. Экспериментальное измерение летучести H2 подтвердило результаты моделирования.
 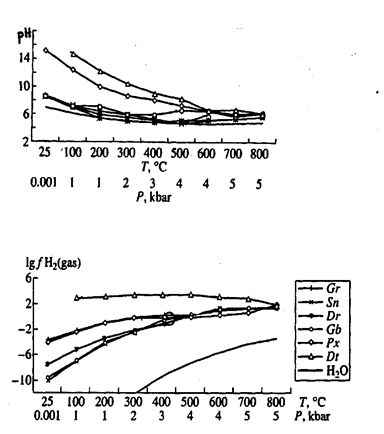  | Окислительно-восстановительный потенциал нонвариантных составов систем «порода-вода» Gr – гранит, Sn – сиенит, Dr – диорит, Gb – габбро (базальт), Px – пироксенит, Dt – дунит, H2O – чистая вода,  – экспериментальные точки |
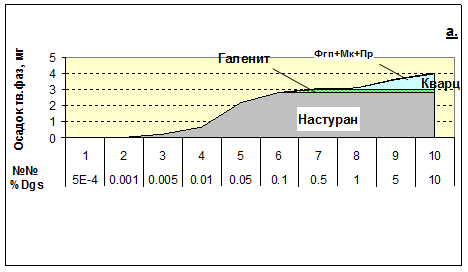
2) При исследовании уранового рудообразования в Рудных Горах установлено, чтобы получить моно-настурановые корки на кристаллизацию которых требуются сотни-тысяч-миллионы лет, должен быть механизм избирательно осаждающий из растворов только уран, но не допускающий выхода в осадок макрокомпонентов р-ра. Этот механизм – смешение U-носного раствора, фильтрующегося по трещинам, с «каплями» поровых р-ров пород повышенной восстановительной емкости. На примере – реакции рудоносного раствора GR, уравновешенного с гранитами, с поровым раствором Dgs (темных слюдистых сланцев)
3) Моделирование уранового рудообразованиения в Забайкалье показало определяющую роль U(IV)-F комплексообразования в мобилизации и высокотемпературном транспорте уран
4) Исследования флюидных включений, лабораторные определения форм существования химических элементов в водном флюиде и компьютерное моделирование процесса образования касситерит-вольфрамитовых рудной минерализации показали, что гетерогенизация флюидов и смешение магматогенных и метеорных вод приводит к осаждению рудных минералов
.
5) Реконструкция эволюции РЗЭ во флюиде при формировании месторождения Иультин позволила определить источники растворов (магматогенный и экзогенный) и пропорцию их смешения на разных стадиях формирования месторождения.
 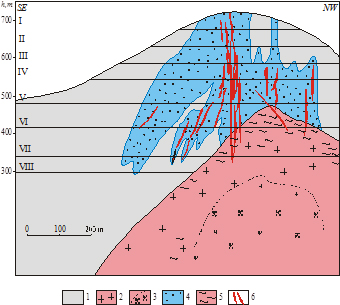 | Схема строения Иультинского месторождения: 1 - осадочно-метаморфические породы; 2 - мусковитовые лейкограниты Иультинского штока (K2); 3 - биотитовые порфировидные лейкограниты Иультинского штока (K2); 4 - околорудные метасоматиты; 5 - грейзенизированные лейкограниты; 6 - рудные тела. |
 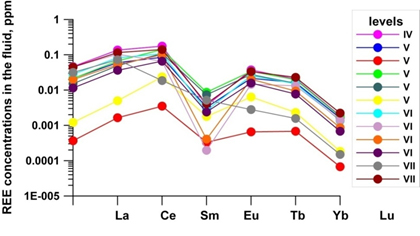 | Расчет содержания РЗЭ во флюиде по составу флюорита. |
 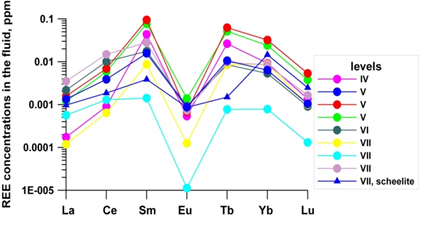 | Расчет содержания РЗЭ во флюиде по составу вольфрамита и шеелита. |
6) Классическую схему рудообразования В.В.Щербины (источник, формы переноса, условия отложения) иллюстрирует модель формирования месторождений в медистых песчаниках: (а) экстракция Cu из минералов изверженных пород (оптимальна при Eh от +200 до -100 мВ, 50оС); (б) Увеличение хлоридности повышает концентрацию Cu в растворе благодаря комплексообразованию Cu(I) с Cl; (в) Ca-Cl рассол (продукт взаимодействия c алевритами Джезказгана) извлекает Cu из красноцветных песчаников, мигрирует в зону с высокой f H2, возникшую вследствие реакции SW3-SW4 с нижележащей карбонатной породой, обогащенной С орг (f О2 при 150оС 10-52бар, при 100оС 10-59бар, при 50оС 10-69бар.)
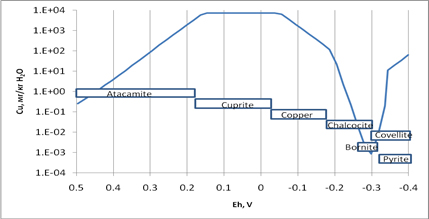

Накопление меди в рудообразующем флюиде, продукте взаимодействия минерализованных вод пород C1 и красноцветных песчаников, как функция Eh системы «вода-порода» при 100оС

